23 сентября 2013 года фармацевтическая компания Янссен Биотек (Janssen Biotech, Inc.) объявила о том, что Управление контроля качества продуктов и лекарственных средств США (Food and Drug Administration, FDA) одобрило применение ее препарата Стелара/ устекинумаб (Stelara/ ustekinumab) в качестве средства монотерапии или в комбинации с метотрексатом (methotrexate) для лечения взрослых (старше 18 лет) с активным псориатическим артритом.
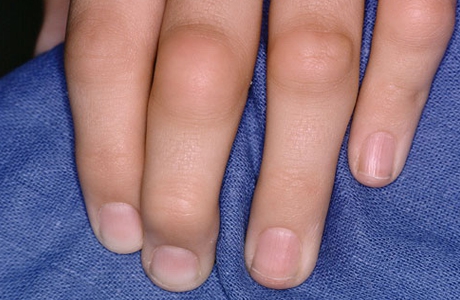
Псориатический артрит
Как сообщает портал МЕДФАРМКОННЕКТ, по словам Алисы Готтлиб (Alice B. Gottlieb), исследователя и члена организационного комитета исследований, ведущего дерматолога Медицинского центра Тафтса (Tufts Medical Center), для дерматологов и ревматологов крайне важно иметь в своем распоряжении новейшие средства для лечения пациентов с псориатическим артритом, заболеванием, для терапии которого необходимы дополнительные биопрепараты.
ЧИТАЙТЕ ТАКЖЕ: Псориатический артрит: когда болеют суставы
По ее мнению, средство, чье действие направлено на цитокины интерлейкин-12 и интерлейкин-23, которые, как считается, играют ключевую роль в развитии данного иммунообусловленного воспалительного заболевания, может улучшить состояние пациентов.
Для лечения псоритатического артрита препарат Стелара в дозировке 45 мг вводится подкожно на 0 и 4 неделе, после чего инъекции проводятся на каждой 12 неделе. Для пациентов с сопутствующим бляшечным псориазом умеренной и тяжелой формы, чей вес превышает 100 кг, рекомендованная доза препарата составляет 90 мг. Одобрение препарата Стелара было основано на данных двух ключевых многоцентровых рандомизированных двойных слепых плацебо-контролированных исследований III Фазы: PSUMMIT I и PSUMMIT II.
В данных испытаниях оценивалась эффективность и безопасность подкожного введения препарата Стелара в дозировках 45 и 90 мг на 0, 4 неделях и впоследствии на каждой 12-ой неделе. В исследованиях приняло участие 927 пациентов с диагностированным активным псориатическим артритом, у которых болезненными и припухлыми были более пяти суставов, а уровень С-реактивного белка составлял, по меньшей мере, 0,3 мг/ дл, в независимости от предыдущего лечения стандартными препаратами. Для испытания PSUMMIT II было также отобрано 180 пациентов, которые ранее получали лечение 1–5 ингибиторами фактора некроза опухоли.
ЧИТАЙТЕ ТАКЖЕ: UCB подала заявку на расширение показаний к применению препарата Кимзия для лечения псориатического артрита
Результаты исследования PSUMMIT 1 показали, что на 24 неделе у 42 и 50 процентов пациентов, получавших препарат Стелара в дозировках 45 и 90 мг, соответственно, было достигнуто, по меньшей мере, 20-процентное улучшение признаков и симптомов по критериям ACR20, которое и являлось первичной конечной точкой обеих испытаний. В исследовании PSUMMIT II ответ по критериям ACR20 на 24 неделе был достигнут у 44% пациентов, получавших препарат Стелара в дозе 45 мг, и у 44% пациентов, которым вводили препарат в дозировке 90 мг.
Кроме того, применение препарата позволило достичь улучшения проявлений заболевания в мягких тканях, включая дактилит (воспаление пальцев), энтезит (воспаление места прикрепления сухожилий или связок к костям), и на коже при измерении по индексу тяжести поражения псориазом (Psoriasis Area and Severity Index score, PASI) 75. Данные испытания PSUMMIT I были опубликованы в издании Ланцет (The Lancet) 13 июня 2013 года.
ЧИТАЙТЕ ТАКЖЕ: Компания Селджен представила результаты исследования препарата для лечения псориатического артрита
Показатели безопасности препарата Стелара, зафиксированные в исследованиях PSUMMIT, были сопоставимы с профилем безопасности Стелара, который установлен при применении для лечения бляшечного псориаза умеренной и тяжелой формы и подтвержден пятью годами клинических испытаний.







 Як вибрати органічне овочеве пюре HiPP для вашої дитини?
Як вибрати органічне овочеве пюре HiPP для вашої дитини?  Бандаж на локоть: что это, и как выбрать
Бандаж на локоть: что это, и как выбрать  Пигментация кожи: что это? Как бороться с пигментацией
Пигментация кожи: что это? Как бороться с пигментацией  Как правильно выбрать массажер для ног?
Как правильно выбрать массажер для ног?  Топ лучших клиник Германии
Топ лучших клиник Германии
Только зарегистрированные пользователи могут оставлять комментарии
Войти