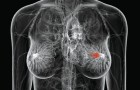
2 сентября 2013 года американская компания Халозим Терапевтикс (Halozyme Therapeutics, Inc.) сообщила о том, что Европейская комиссия (European Commission) одобрила использование в странах ЕС препарата Герцептин/ трастузумаб (Herceptin/ trastuzumab) в форме для подкожного введения, которая позволит ускорить процедуру применения препарата.

Утвержден препарат Герцептин для лечения HER2-позитивного рака молочной железы
Как сообщает портал МЕДФАРМКОННЕКТ, данное лекарственное средство компании Рош (Roche) предназначено для лечения HER2-положительного рака молочной железы. В его новой форме выпуска использована технология американской компании Халозим Терапевтикс, которая обеспечивает обратимое разрушение гиалуроновой кислоты – гелеобразного вещества, образующего барьер между клетками в подкожном слое.
ЧИТАЙТЕ ТАКЖЕ: Новая форма выпуска препарата Герцептин для лечения рака молочной железы рекомендована для одобрения в Европе
Подкожное введение препарата занимает от двух до пяти минут по сравнению с 30–90 минутами при использовании препарата Герцептин для внутривенного применения. Как заявил президент и генеральный директор компании Халозим Грегори Фрост (Gregory Frost), данное одобрение является отличной новостью для более чем 80 тысяч пациенток из Европы, которые ежегодно применяют Герцептин. Сокращение времени введения и большая простота в применении препарата позволят европейским пациенткам меньше пребывать в лечебных учреждениях. По словам директора Халозим, в его компании рады, что их разработка вскоре сможет помочь тысячам пациенток.
Европейское одобрение новой формы выпуска препарат Герцептин было основано на данных исследования HannaH. В нем было продемонстрировано, что Герцептин для подкожного введения обладает эффективностью (по показателю полного морфологического ответа, pCR) сопоставимой с эффективностью Герцептина при внутривенном введении у женщин, больных HER2-позитивным раком молочной железы на ранней стадии.
ЧИТАЙТЕ ТАКЖЕ: Тревожные признаки рака молочной железы
При использовании Герцептина для подкожного введения концентрация трастузумаба в сыворотке крови была не ниже, чем при использовании формы для внутривенного введения. Профиль безопасности в обеих группах исследования HannaH в целом был сопоставим с тем, который ожидался от стандартного применения Герцептина и химиотерапии в данном режиме. Новых данных по безопасности выявлено не было.








 Як вибрати органічне овочеве пюре HiPP для вашої дитини?
Як вибрати органічне овочеве пюре HiPP для вашої дитини?  Бандаж на локоть: что это, и как выбрать
Бандаж на локоть: что это, и как выбрать  Пигментация кожи: что это? Как бороться с пигментацией
Пигментация кожи: что это? Как бороться с пигментацией  Как правильно выбрать массажер для ног?
Как правильно выбрать массажер для ног?  Топ лучших клиник Германии
Топ лучших клиник Германии
Только зарегистрированные пользователи могут оставлять комментарии
Войти