Европейский союз расширил сводную характеристику препарата Превенар 13/ 13-валентной конъюгированной пневмококковой вакцины, разработанной американской фармацевтической компанией Пфайзер (Pfizer).
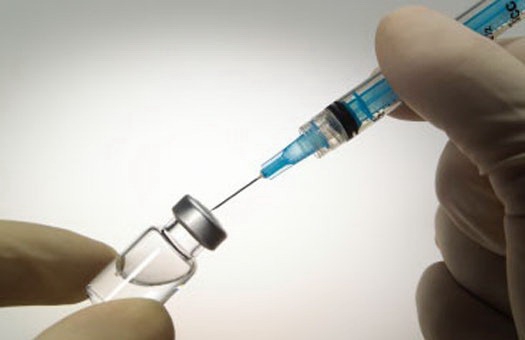
В Европе расширили показания к применению вакцины Превенар 13 компании Пфайзер
Теперь препарат может использоваться для вакцинации недоношенных новорожденных, пациентов детского возраста, подростков, страдающих серповидноклеточной анемией, а также для лечения взрослых с ВИЧ-инфекцией, которые ранее были вакцинированы 23-валентной полисахаридной пневмококковой вакциной.
ЧИТАЙТЕ ТАКЖЕ: В Европе рекомендовали к одобрению пневмококковую вакцину Синфлорикс компании ГлаксоСмитКляйн

Решение о расширении показаний к применению препарата Превенар 13 последовало после рассмотрения Европейским агентством по лекарственным препаратам (European Medicines Agency, ЕМА) данных, представленных компанией Пфайзер, из нескольких клинических испытаний по оценке иммуногенности и безопасности данной вакцины.
ЧИТАЙТЕ ТАКЖЕ: В Европе одобрили вакцину Превенар 13 компании Пфайзер для профилактики пневмококковой инфекции
Также данные результаты исследований рассматриваются Управлением контроля качества продуктов и лекарственных средств США (Food and Drug Administration, FDA). В июле 2013 Европейская комиссия разрешила использовать вакцину Превенар 13 для применения у взрослых в возрасте от 18 до 49 лет для активной иммунизации и профилактики инфекционных заболеваний, вызванных Streptococcus pneumoniae (S. pneumoniae).




 Як вибрати органічне овочеве пюре HiPP для вашої дитини?
Як вибрати органічне овочеве пюре HiPP для вашої дитини?  Бандаж на локоть: что это, и как выбрать
Бандаж на локоть: что это, и как выбрать  Пигментация кожи: что это? Как бороться с пигментацией
Пигментация кожи: что это? Как бороться с пигментацией  Как правильно выбрать массажер для ног?
Как правильно выбрать массажер для ног?  Топ лучших клиник Германии
Топ лучших клиник Германии
Только зарегистрированные пользователи могут оставлять комментарии
Войти